MicroRNA (miRNA) 研究方法全面总结
miRNA是一类长度约为22个核苷酸的非编码单链小RNA,在转录后水平通过靶向mRNA的3'非翻译区(3' UTR)来降解靶基因或抑制其翻译,从而在细胞增殖、分化、凋亡、代谢等几乎所有生命活动中发挥关键的调控作用,miRNA的异常表达与多种疾病(尤其是癌症)的发生发展密切相关,因此成为当前生命科学和医学研究的热点。
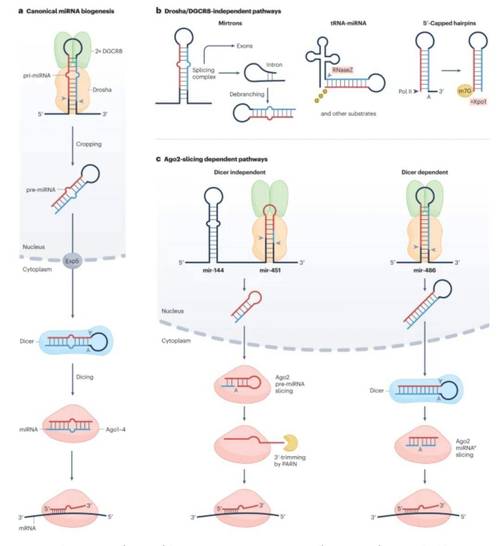
以下是miRNA研究的系统性方法总结,通常遵循以下逻辑链条:发现差异表达 → 功能预测与验证 → 机制深入探讨 → 临床转化应用。
第一部分:miRNA的发现与差异表达分析
这是miRNA研究的起点,旨在从海量miRNA中筛选出与特定生物学过程或疾病状态相关的候选miRNA。
高通量筛选技术
-
A. 微阵列芯片
- 原理: 将已知的miRNA探针固定在芯片上,用荧光标记的待测样本(如组织、细胞总RNA)进行杂交,通过检测荧光信号的强度来定量分析miRNA的表达水平。
- 优点:
- 通量高,可一次性检测成百上千种miRNA。
- 成本相对较低。
- 技术成熟,数据可比性强。
- 缺点:
- 灵敏度有限,对于低丰度miRNA检测效果不佳。
- 只能检测已知miRNA,无法发现新的miRNA。
- 存在交叉杂交风险。
- 应用: 大样本量的miRNA表达谱筛选,如寻找癌症生物标志物。
-
B. RNA测序
 (图片来源网络,侵删)
(图片来源网络,侵删)- 原理: 将样本中的总RNA(或小RNA组分)构建成cDNA文库,然后进行高通量测序,通过生物信息学分析,将测序序列与已知miRNA数据库比对,即可得到miRNA的表达谱和定量信息,还能发现新的miRNA。
- 优点:
- 灵敏度极高,可检测到丰度极低的miRNA。
- 动态范围广,能准确区分表达量差异大的miRNA。
- 无偏性,不仅能检测已知miRNA,还能发现新的miRNA。
- 能提供miRNA的异构体信息。
- 缺点:
- 成本较高。
- 数据分析流程复杂,对生物信息学能力要求高。
- 需要大量起始RNA(但已有针对微量样本的建库方案)。
- 应用: 当前的金标准,适用于差异表达分析、新miRNA发现、miRNA编辑等研究。
特定miRNA的定量验证
高通量筛选后,需要对候选miRNA进行精确的定量验证。
-
A. 茎环法实时荧光定量PCR (Stem-loop RT-qPCR)
- 原理: 使用带有特殊茎环结构的逆转录引物,将成熟的miRNA逆转录成较长的cDNA,然后设计特异性正向引物和通用反向引物进行qPCR检测。
- 优点:
- 特异性极高,能有效区分成熟miRNA和其前体pri-miRNA/pre-miRNA。
- 灵敏度极高,可检测到单个细胞水平的miRNA。
- 准确性好,重复性高。
- 缺点:
- 一次只能检测一个miRNA,通量低。
- 需要针对每个miRNA设计特异性引物。
- 应用: 差异表达验证的金标准,适用于少量关键miRNA的精确定量。
-
B. 探针法实时荧光定量PCR (TaqMan Probe-based RT-qPCR)
- 原理: 与茎环法类似,但使用TaqMan探针(带有荧光报告基团和淬灭基团)进行检测,探针与目标cDNA特异性结合,PCR延伸时探针被降解,报告基团释放荧光。
- 优点:
- 特异性与茎环法相当。
- 可以设计多重荧光通道,实现多重检测。
- 缺点:
成本高于茎环法。
 (图片来源网络,侵删)
(图片来源网络,侵删) - 应用: 特别适合需要同时检测多个miRNA或内参基因的场景。
第二部分:miRNA的功能研究
找到差异表达的miRNA后,需要研究其在细胞或生物体中的生物学功能。
miRNA功能获得
- 方法:miRNA模拟物 / miRNA前体
- 原理: 将化学合成的成熟miRNA双链模拟物或能表达成熟miRNA的质粒载体转染/导入细胞,使其在细胞内过表达,从而模拟miRNA高表达状态。
- 应用: 研究miRNA过表达对细胞表型(如增殖、凋亡、迁移、侵袭等)的影响,或验证其对靶基因的抑制作用。
miRNA功能缺失
- 方法:miRNA抑制剂 / Antagomirs
- 原理:
- 化学合成抑制剂: 设计与成熟miRNA序列互补的单链寡核苷酸(如Antagomirs, LNA-antimiR),通过其“诱饵”作用,特异性地结合并中和内源的miRNA,使其无法与靶基因结合。
- 海绵载体: 构建一个表达载体,载体上串联多个与目标miRNA完全互补的“结合位点”(即miRNA Response Elements, MREs),当该载体在细胞中表达时,会产生大量的“miRNA海绵”,像海绵一样吸附内源的miRNA,从而抑制其功能。
- 应用: 研究抑制特定miRNA后对细胞表型的影响,或验证其在特定通路中的必要性。
- 原理:
第三部分:miRNA下游靶基因及机制研究
这是miRNA研究的核心,即阐明miRNA“调控了什么”。
生物信息学预测
- 原理: 基于miRNA与靶基因结合的核心规则(如种子序列匹配、结合自由能等),利用算法预测miRNA的潜在靶基因。
- 常用数据库/工具: TargetScan, miRanda, PicTar, miRDB, starBase等。
- 注意: 预测结果必须通过实验验证! 任何一种算法都存在假阳性。
实验验证
-
A. 双荧光素酶报告基因实验
- 原理: 将目标基因3' UTR中预测的miRNA结合序列(野生型)克隆到荧光素酶报告载体下游,构建一个突变体载体,将结合序列中的关键碱基进行突变,将这两种载体分别与miRNA模拟物或共转染到细胞中,如果miRNA能靶向该3' UTR,则野生型载体的荧光素酶活性会显著下降,而突变体则不受影响。
- 优点: 直接、快速地验证miRNA与靶基因3' UTR的直接结合关系。
- 缺点: 只能验证结合,不能完全反映在细胞内真实的调控效果(可能受其他因素影响)。
- 应用: 验证靶基因的金标准。
-
B. Western Blot / qPCR
- 原理: 在过表达miRNA模拟物或抑制miRNA的细胞中,通过Western Blot检测靶蛋白水平的变化,或通过qPCR检测靶mRNA水平的变化。
- 解读:
- 如果miRNA导致靶mRNA和蛋白水平同时下降,说明该miRNA主要通过降解靶mRNA发挥作用。
- 如果只导致靶蛋白水平下降,而mRNA水平不变,说明该miRNA主要通过抑制翻译发挥作用。
- 应用: 验证miRNA对靶基因的调控效果,并初步判断其作用机制。
全局靶基因筛选
-
A. AGO免疫共沉淀测序
- 原理: miRNA与其靶mRNA形成RNA诱导沉默复合物,核心蛋白是Argonaute (AGO),利用特异性抗体将AGO蛋白及其结合的mRNA(即miRNA的靶mRNA)共沉淀下来,然后对这些mRNA进行测序分析。
- 优点: 无偏性地、在细胞内生理状态下,直接捕获所有被特定miRNA调控的靶基因。
- 缺点: 技术要求高,成本高。
- 应用: 在全基因组范围内寻找miRNA的直接靶基因,常用于新miRNA的功能机制研究。
-
**B. 蛋白质