以下是当前细胞和分子免疫研究领域的几大核心热点,我将从机制探索、技术革新和应用转化三个维度进行阐述。
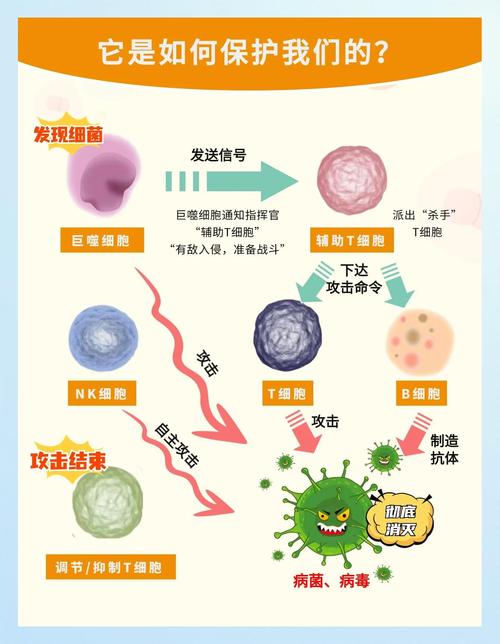
免疫细胞功能的精细调控机制
这个领域旨在深入理解不同免疫细胞是如何被激活、抑制、分化和记忆的,其核心是信号通路和表观遗传调控。
T细胞亚群的分化与功能调控
T细胞是免疫系统的“总指挥”,其亚群的平衡与功能是免疫研究的核心。
- T细胞耗竭: 在慢性感染和肿瘤微环境中,T细胞会逐渐失去功能,进入“耗竭”状态,研究热点包括:
- 耗竭的分子特征与可逆性: 通过单细胞测序等技术,绘制耗竭T细胞的动态发育图谱,发现新的调控分子(如转录因子、表面标记物),并探索如何逆转耗竭状态以用于癌症免疫治疗(如“耗竭T细胞重编程”)。
- 耗竭的代谢重编程: 耗竭T细胞的代谢途径(如糖酵解、氧化磷酸化)发生改变,研究如何通过调节代谢来恢复其功能。
- 组织驻留记忆T细胞: TRM细胞长期驻留在外周组织(如皮肤、肺、肠道),是抵御病原体入侵的第一道防线,研究热点包括:
- TRM细胞的组织特异性: 不同组织的微环境如何塑造TRM细胞的表型和功能。
- TRM细胞的诱导与维持: 如何通过疫苗设计或过继性细胞疗法来高效诱导和维持长效的TRM细胞,提供持久保护。
- 调节性T细胞: Treg细胞是维持免疫耐受的关键,其功能异常会导致自身免疫病或肿瘤免疫逃逸。
- Treg细胞的稳定性与可塑性: 在炎症或肿瘤微环境中,Treg细胞如何维持其抑制功能,或者“叛变”为具有促炎效应的细胞。
- Treg细胞在肿瘤治疗中的“双刃剑”作用: 如何在抑制有害Treg细胞以增强抗肿瘤免疫的同时,避免破坏其维持自身耐受的功能。
固有免疫的识别与信号通路
固有免疫是先天性的第一道防线,其识别和信号传导机制是研究热点。
- 模式识别受体:
- cGAS-STING通路: 这是胞内DNA感受的明星通路,它不仅在抗病毒、抗肿瘤中起关键作用,也与自身免疫病和衰老密切相关,研究热点包括开发STING激动剂作为抗癌佐剂,以及理解其在不同细胞类型(如成纤维细胞、内皮细胞)中的非经典功能。
- NLRP3炎症小体: 作为感受多种危险信号(如 crystals, ATP)的核心平台,其过度激活与多种炎症性疾病相关,研究热点在于其精确的激活机制、调控蛋白以及开发特异性抑制剂。
- 天然淋巴细胞: ILCs(如ILC1, ILC2, ILC3)是连接先天免疫和适应性免疫的桥梁,在组织稳态、炎症和抗感染中发挥重要作用,研究热点是其发育谱系、组织驻留特性以及与肠道菌群、神经系统等的互作。
免疫微环境的复杂性与互作网络
免疫反应不是单个细胞的独角戏,而是在一个复杂的“生态系统”——免疫微环境中进行的。
肿瘤免疫微环境
这是当前最热门的方向之一,旨在“驯服”肿瘤的免疫抑制环境。
- 髓系细胞: 肿瘤相关巨噬细胞、髓系来源的抑制细胞等是TMD的主要“帮凶”,它们通过多种机制抑制抗肿瘤免疫,研究热点包括:
- 髓系细胞的可塑性与重编程: 如何将免疫抑制型的髓系细胞重编程为免疫激活型。
- 靶向髓系细胞的策略: 开发针对CSF-1R、CD47等靶点的药物,以清除或重塑这些细胞。
- 代谢微环境: 肿瘤细胞和免疫细胞会竞争有限的营养物质(如葡萄糖、氨基酸),导致免疫细胞功能受损,研究热点包括:
- 免疫代谢检查点: 发现并靶向调控免疫细胞代谢的关键酶或转运体(如IDO、精氨酸酶)。
- 膳食干预与免疫: 研究特定饮食(如生酮饮食)如何通过改变代谢微环境来增强免疫治疗效果。
- 淋巴结构成: 在肿瘤内部形成三级淋巴结构是产生有效抗肿瘤免疫反应的标志,研究热点是如何通过治疗手段(如免疫联合治疗)来诱导TLS的形成。
组织驻留免疫细胞与器官稳态、修复
除了T细胞,其他免疫细胞(如巨噬细胞、树突状细胞)也在器官稳态和损伤修复中扮演关键角色。
- 器官特异性巨噬细胞: 不同器官(如肝、肺、脑)的巨噬细胞具有独特的起源和功能,研究热点是它们如何参与器官发育、组织修复和纤维化,以及如何靶向它们治疗相关疾病。
- 神经-内分泌-免疫轴: 免疫系统与神经系统、内分泌系统存在双向交流,迷走神经刺激可以调节炎症反应,肠道菌群代谢物可以影响免疫细胞功能,这是一个新兴的、充满交叉学科魅力的领域。
技术革新驱动的新发现
技术的突破是推动免疫学发展的核心引擎。
单细胞与空间多组学技术
- 单细胞RNA测序: 已经成为标准技术,用于解析细胞异质性、发现新的细胞亚群、追踪细胞发育轨迹。
- 空间转录组/蛋白组: 这是当前最前沿的技术之一,它不仅能知道“有什么细胞”,还能知道“这些细胞在哪里”、“它们之间如何互作”,这对于理解TME、淋巴器官结构、大脑免疫等复杂组织中的免疫细胞空间排布和功能至关重要。
- 单细胞ATAC测序/蛋白质组学: 结合基因表达和表观遗传/蛋白质状态,实现多维度的细胞功能分析。
基因编辑与细胞工程
- CRISPR-Cas9技术: 不仅用于基础研究(基因功能筛选),也正在走向临床(如CAR-T细胞基因编辑以增强其功能或安全性)。
- 合成生物学与细胞治疗:
- 下一代CAR-T/TCR-T疗法: 设计更智能的CAR-T细胞,如逻辑门控CAR-T(需要两个肿瘤抗原同时存在才被激活)、可调控CAR-T(通过口服药物开关控制其活性),以解决脱靶效应和细胞因子风暴等问题。
- 通用型CAR-T: 通过基因编辑敲除T细胞的T细胞受体和HLA分子,制备“现货”型细胞产品,降低成本和等待时间。
AI与大数据免疫学
人工智能正在深刻改变免疫学研究范式。
- 预测新抗原: 利用AI算法分析肿瘤的基因突变,高效预测能被T细胞识别的新抗原,指导个性化新抗原疫苗的开发。
- 抗体/TCR设计: 利用深度学习模型从头设计具有特定亲和力和特异性的抗体或T细胞受体。
- 整合多组学数据: AI可以整合来自基因组、转录组、蛋白质组、代谢组的海量数据,构建复杂的免疫调控网络模型,发现新的生物标志物和治疗靶点。
跨领域融合与临床转化
肠道菌群与免疫
肠道微生物组是人体的“第二基因组”,深刻影响宿主的免疫系统。
- 菌群-免疫轴: 特定菌群的代谢物(如短链脂肪酸)如何通过调节免疫细胞(如Treg细胞)来维持肠道稳态、影响全身免疫反应。
- 菌群与疾病: 研究菌群失调如何导致自身免疫病(如I型糖尿病)、过敏,以及如何通过粪菌移植或益生菌来调节免疫、辅助治疗肿瘤。
免疫衰老
随着年龄增长,免疫系统功能衰退,导致对疫苗反应减弱、感染易感性增加和肿瘤发生率升高。
- 免疫细胞的衰老特征: 研究T细胞、B细胞、髓系细胞在衰老过程中的表型和功能变化。
- 延缓免疫衰老的策略: 探索通过生活方式干预、药物或年轻细胞输注等方式来逆转或延缓免疫衰老。
当前细胞和分子免疫研究的特点是:
- 从“单一”到“系统”: 不再孤立地研究单个分子或细胞,而是将其置于复杂的微环境和网络中。
- 从“描述”到“预测”: 在高通量技术获取海量数据的基础上,利用AI进行建模和预测。
- 从“基础”到“临床”: 基础研究的发现正以前所未有的速度转化为新的诊断工具和治疗方法,尤其是在肿瘤免疫领域。
这些热点不仅代表了科学的前沿,也预示着未来医学发展的方向——更加精准、个体化和高效地利用人体自身的免疫系统来战胜疾病。