新药的临床研究必须通过 伦理审查委员会(Institutional Review Board, IRB)或伦理审查委员会(Ethics Committee, EC)的批准。
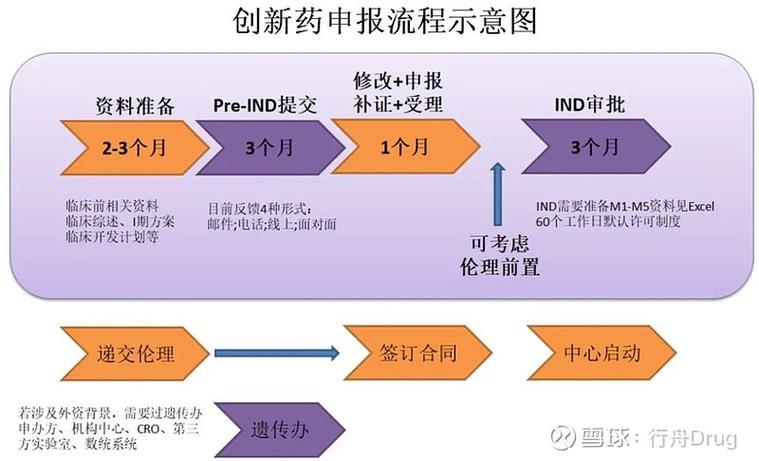
这是一个强制性且至关重要的步骤,是新药从实验室走向人体的“通行证”和“安全阀”。
以下是详细的解释:
为什么必须通过伦理审查?
伦理审查的核心目的是保护受试者的权益、安全和福祉,它确保:
- 受试者的安全是第一位的:任何潜在的风险都必须被充分评估,并且风险与潜在的获益相比必须是合理的。
- 受试者的知情权:研究者必须向潜在的受试者全面、清晰地说明研究的所有信息,包括研究目的、流程、潜在的风险与获益、替代治疗方案等,并在其自愿同意后才能开始。
- 研究的科学性与伦理性:确保研究设计科学、合理,并且有充分的科学依据支持,避免不必要的实验。
- 公平性:确保受试者的选择是公平的,不存在任何形式的强迫或不当引诱。
伦理审查委员会 的角色和职责
IRB/EC 是一个独立的多学科委员会,其成员通常包括医学专家、非医学科学家(如统计学家)、律师、伦理学家以及社区代表(代表普通公众的视角)。

在审查新药临床研究方案时,他们会重点关注以下几个方面:
- 研究方案的科学与伦理性:研究假设是否成立?设计是否科学严谨?
- 受试者的风险与获益评估:预期的风险是否可控?潜在的获益是否大于风险?
- 知情同意过程的充分性:知情同意书的内容是否清晰易懂?是否能确保受试者是真正自愿参与?
- 招募受试者的公平性:招募方式是否公平,不会利用弱势群体?
- 对受试者隐私和保密的保护措施:如何保护受试者的个人医疗信息不被泄露?
- 研究者资质与经验:负责研究的人员是否具备相应的资质和能力?
- 不良事件的应对预案:如果发生意外伤害或严重不良反应,是否有完善的处理和上报流程?
只有当 IRB/EC 认为研究方案符合所有伦理和法律要求,能够充分保障受试者的权益和安全时,才会批准该研究项目(或称为“批准方案”,Approve the Protocol)。
审查流程
-
提交申请:研究者或申办方(通常是制药公司)需要向 IRB/EC 提交完整的申请材料,包括:
- 临床研究方案
- 知情同意书
- 研究者简历和资质证明
- 研究药物的背景资料(如非临床研究数据)
- 其他相关文件
-
会议审查:IRB/EC 会定期召开会议,对所有提交的申请进行集体讨论和审议,对于高风险的研究,通常会采用会议审查的形式。
 (图片来源网络,侵删)
(图片来源网络,侵删) -
做出决定:审查后,IRB/EC 会做出以下决定之一:
- 批准:研究可以按方案进行。
- 作必要的修改后批准:研究需要根据 IRB/EC 的意见进行修改,修改后无需再次上会即可批准。
- 修改后重审:研究需要进行重大修改,修改后需要再次提交给 IRB/EC 进行审查。
- 不批准:研究方案存在严重问题,不符合伦理要求,不予批准。
-
持续监督:伦理审查不是一次性的,在研究进行过程中,IRB/EC 会持续监督研究的进展,要求研究者定期提交研究报告,并及时报告任何严重不良事件,如果发现新的问题或风险,IRB/EC 有权暂停甚至终止研究。
新药的临床研究必须通过伦理审查委员会的批准,这是全球各国药品监管机构(如中国的NMPA、美国的FDA、欧洲的EMA)的强制性法规要求,是新药研发过程中不可或缺的、以人为核心的伦理保障环节,没有 IRB/EC 的批准,任何涉及人体的新药临床研究都不能启动。